本文作者:羽衣
这是一款拥有传奇故事的药。
2020 年,它作为突破性疗法获得美国 FDA 加速批准,2 年半后因 Ⅲ 期临床未达终点撤市,被称为「史上最快撤市的加速批准抗癌药」。
不过,尽管暂时离开了美国市场,这款药却接连在英国、日本、加拿大、瑞士和阿联酋多国获批上市。有专家评价道:「疗效在临床中是可以切实感受到的。它的出现将拓展晚期骨髓瘤的治疗维度。」[1]
又过了 2 年半后,这款药携两项傲人的 Ⅲ 期临床结果再次向 FDA 提出申请,却再次因副作用问题引发争议。参与最终投票的专家,都直呼这票太难投。
这次,它能成功回归吗?
加速批准的「明星药」
玛贝兰妥单抗(Blenrep)是全球首款靶向 B 细胞成熟抗原(BCMA,多发性骨髓瘤治疗的重要靶点)的抗体-药物偶联物(ADC),用于多发性骨髓瘤的药物,由葛兰素史克(GSK)开发。
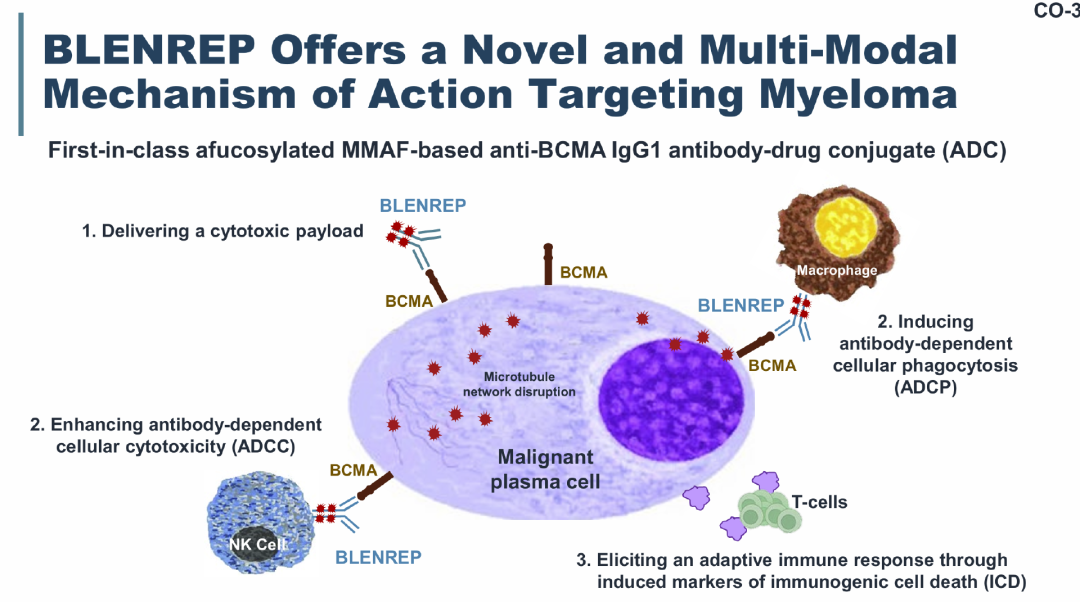
玛贝兰妥单抗怎么抗肿瘤?可以理解为「两条腿走路」:
一方面,抗体部分与骨髓瘤细胞表面的 BCMA 高亲和力结合,使 ADC 内含的毒素进入肿瘤细胞,引发细胞周期阻滞和肿瘤细胞凋亡;
另一方面,抗体与 BCMA 结合后可招募免疫效应细胞,通过 ADCC 效应从外部杀伤骨髓瘤细胞。
图源:文献 3
同时,药物设计使得毒素可以主要在肿瘤细胞内发挥作用,具有足够特异性,对周围组织的毒性小。
DREAMM-2(II 期)是支持玛贝兰妥单抗注册的关键单臂临床试验,入组了既往接受过多种疗法,蛋白酶体抑制剂、免疫调节药、抗 CD38 单抗三种药物效果都不佳的多发性骨髓瘤患者,分别接受玛贝兰妥单抗静脉注射 2.5 mg/kg 或 3.4 mg/kg,每三周一次,主要疗效终点设置为「总体缓解率」(ORR)。
该研究结果显示,在推荐剂量 2.5 mg/kg 组中 ORR 达到 31%(97.5%CI 21~43%),且约 73% 的应答患者缓解持续时间 ≥6 个月。
这样的疗效,对于这批难治性的患者,无疑有重要临床价值。
于是,玛贝兰妥单抗很快获得了美国 FDA 授予的突破性疗法认定以及孤儿药资格,2020 年 8 月就正式取得了加速批准,用于治疗接受过至少 4 种疗法后仍复发/难治的多发性骨髓瘤成年患者。

图源:文献 4
这是美国 FDA 批准的首个抗 BCMA 的 ADC 药物,标志着 ADC 技术在血液肿瘤领域的新突破,也一度是解决「三重难治」骨髓瘤的希望之星。
由于该药被 FDA 认定为「孤儿药」(即影响美国少于 20 万人的药物),且针对的是严重的、危及生命的、尚无有效疗法的疾病,因而美国 FDA 给予了其加速审批,允许基于「替代性终点」获批(例如 DREAMM-2 终点就是「总体缓解率」而不是患者的长期生存率)。
「加速批准」能让无药可用的患者更早地用上药,但同时也会面临一定的风险。因此获得加速审批的药物,需要在上市后开展临床试验,以进一验证其长期疗效和安全性。
对于玛贝兰妥单抗,一个重要的问题在于眼部毒性。
尽管 BCMA 并不在眼部表达,但玛贝兰妥单抗会通过胞饮作用被角膜上皮细胞摄取。而角膜上皮细胞更新速度更快,更容易受害出现微囊性角膜病变,症状为视力模糊、干眼、眼痛等症状。
虽然通常停药这些症状能够消退,但依然是无法忽视的安全性问题。
因此,FDA 要求 GSK 开展确证性试验,且上市后实行严格的风险评估和缓解策略计划,要求所有处方医师和患者都接受角膜安全性监测教育,并在每次给药前后进行眼科检查,以管理其严重角膜相关不良反应风险。
同时,美国的玛贝兰妥单抗也只能通过特殊供应渠道提供。
但即便在这样的限制条件下,玛贝兰妥单抗的市场表现仍然不俗:5 个月内销售额已达 4300 万美元,次年全球销售额就破了一亿美元大关。
3 期临床折戟,创最快退市纪录
然而,天不遂人愿。
2022 年下半年,玛贝兰妥单抗的确证性 3 期临床试验 DREAMM-3 结果公布。
该研究直接对比玛贝兰妥单抗单药与标准治疗 Pomalidomide(泊马度胺)+低剂量地塞米松(PomDex)在 R/R 多发性骨髓瘤患者(至少经治 2~3 线)中的疗效,主要终点为无进展生存期(PFS)。
结果显示:总体缓解率方面玛贝兰妥单抗依然表现不错,为 41%,高于对照组的 36%,且缓解显著的比例 25% 显著高于对照组的 8%。
但在最为重要的 PFS 上,玛贝兰妥单抗的中位 PFS 为 11.2 个月,对照 PomDex 组为 7.0 个月,没达到统计学显著的差异(HR=1.03,95% CI 0.72~1.47)。
安全性上,玛贝兰妥单抗组的毒性与此前研究一致,3 级角膜病变发生率与先前研究相当 。
简而言之,虽然缓解率有优势,但未达主要终点,角膜毒性依然较强。
该数据直接动摇了「加速批准」的数据支撑,美国 FDA 迅速对其风险收益比提出质疑。
2022 年 11 月 22 日,GSK 宣布应 FDA 要求启动美国市场的玛贝兰妥单抗撤市程序。

图源:GSK 官网
次年 3 月,该药生物制品许可撤销,FDA 给出的撤市原因是「确证性 Ⅲ 期试验未能验证临床效益(PFS 未显著优于对照)」。
至此,玛贝兰妥单抗成了 FDA 加速批准史上最快退市的肿瘤药物。新患者无法再通过商业途径获得玛贝兰妥单抗,但 GSK 仍可以为已明确有临床获益的正在用药的患者,继续提供非商业化的用药方案。
新 3 期结果喜人,GSK 开启复活战
玛贝兰妥单抗退市时,多发性骨髓瘤领域的其他 BCMA 疗法正在大放异彩,如 BCMA CAR-T 细胞疗法 idecel 和 cilta-cel,首款 BCMA 双特异性抗体 teclistamab 相继获批。
再看回玛贝兰妥单抗,虽然 DREAMM-3 主要终点没达到,但缓解率上依然表现出了优势。
GSK 没有甘心就这样给玛贝兰妥单抗画下句点。或许 DREAMM-3 的阴性结果,是因为单药疗效有局限性。于是,GSK 将新的希望寄托于玛贝兰妥单抗的另两项联合用药 Ⅲ 期临床试验。
退市 2 年半后,DREAMM-7、8 两项试验带来了喜人的结果。

图源:文献 3
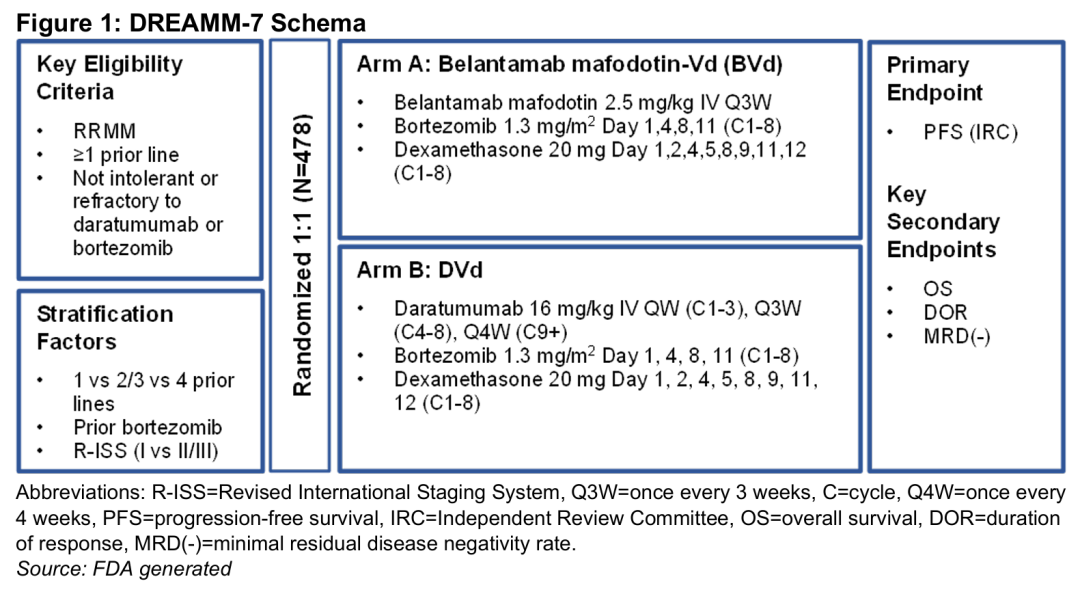
DREAMM-7 将玛贝兰妥单抗联合硼替佐米+地塞米松(BVd),与达雷木单抗(抗 CD38 单抗)联合硼替佐米+地塞米松(DVd)头对头比较,用于至少接受过 1 项一线治疗后复发的,或难治性的多发性骨髓瘤患者。
试验入组了 494 名患者,试验组每 3 周玛贝兰妥单抗剂量为 2.5 mg/kg(静脉给药),主要终点是 PFS。
DREAMM-7 达到了主要终点,BVd 方案显著延长了 PFS。中期分析显示,BVd 组中位 PFS 达 36.6 个月,相比对照组提升近 3 倍,且疾病进展或死亡风险降低约 60%,ORR 和深度缓解率也优于对照。
DREAMM-8 则将玛贝兰妥单抗联合泊马度胺+地塞米松(BPd)与硼替佐米+泊马度胺+地塞米松(PVd)进行对比,入组 302 名患者(所有患者既往均使用过来那度胺,78% 对来那度胺耐药,约 1/4 用过达雷木单抗),同样也达到了主要终点(PFS),总体疗效指标(ORR、缓解深度等)均优。

图源:文献 2
带着这批最新研究数据,GSK 再次着手开始推动玛贝兰妥单抗联合疗法的审批。
专家组投票不支持,FDA 延期「终审」
但回归的路并不好走,原因同样在于副作用问题。
玛贝兰妥单抗组合方案组相较对照组,都出现了更高比例的 3 级以上不良事件,包括血液学毒性(血小板减少、感染等)和角膜事件。角膜内皮炎(KVA)事件不仅发生率高,还较为严重:两项试验分别有高达 77% 和 78% 的患者出现过 3~4 级 KVA 事件。
研究者强调,角膜事件可管理、多数通过剂量调整等措施可以恢复,试验中因眼毒性停药率不高(≤9%),但尽管如此,这一结果仍然引起了争议。
7 月 17 日,FDA 肿瘤药物咨询委员会(ODAC)召开会议,就 GSK 对玛贝兰妥单抗联用疗法的批准申请进行了辩论。
问题的焦点,依然在于眼部毒性。

图源:文献 2
根据 7 月 17 日会议前的公开简报,FDA 指出,在参加 2 项 Ⅲ 期研究的患者均观察到「高眼毒性率」,治疗「与角膜溃疡等严重眼毒性相关」。
有媒体报道,参与投票的专家都认为此番投票争议很大,甚至有一位专家认为这是他担任 ODAC 委员会成员以来最困难的投票:「因为疗效数据非常稳健,但毒性也同样显著。」
最终,ODAC 委员给出了两项残酷的投票结果:
玛贝兰妥单抗联合硼替佐米+地塞米松:5 票反对、3 票支持;玛贝兰妥单抗联合泊马度胺+地塞米松:7 票反对、1 票支持。
消息一出,也有不少人为玛贝兰妥单抗惋惜。唯一一名对两种联用方案都支持的专家 John DeFlice 评价道:「这是一种治疗不治之症的神奇药物」。
需要强调的是,专家咨询委员会的投票并不直接决定最终审批结果。根据 FDA 此前消息,关于玛贝兰妥单抗的最终审批结果原定在当地时间 7 月 23 日作出。
不过,今晨再度传来新消息,FDA 将最终审批结果延期至 2025 年 10 月 23 日,以审查 GSK 所提交的补充材料。

GSK 官网截图
这一变化发生后,市场对玛贝兰妥单抗的信心也有所回温——GSK 股价呈现出了小幅的反弹上扬。
GSK 在公告中表示,对支持玛贝兰妥单抗组合疗法的数据充满信心,并将积极与 FDA 在审评过程中持续保持对话。
根据今年早些时候 GSK 对玛贝兰妥单抗的销售预测,其峰值年销售额有望超过 30 亿英镑(约合人民币 290 亿元)。
玛贝兰妥单抗能否峰回路转,仍需拭目以待。(策划:z_popeye|监制:islay)
题图来源:玛贝兰妥单抗包装
参考资料:
[1]https://www.wsj.com/health/pharma/gsks-blood-cancer-treatment-combinations-approved-in-japan-6be187a4
[2]https://www.fda.gov/media/187578/download
[3]https://www.fda.gov/media/187658/download
[4]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-granted-accelerated-approval-belantamab-mafodotin-blmf-multiple-myeloma
[5]https://www.fda.gov/drugs/resources-information-approved-drugs/withdrawn-cancer-accelerated-approvals
[6]https://www.fiercepharma.com/pharma/fda-advisors-spurn-gsks-blenrep-comeback-dreams-safety-trial-concerns
[7]https://www.fda.gov/advisory-committees/july-17-2025-meeting-oncologic-drugs-advisory-committee-07172025
编辑:ifhealth 来源:丁香园
