肌萎缩侧索硬化症(ALS),即俗称的「渐冻症」,长期以来都因为症状严重但缺医少药备受关注。
2025 年 6 月 10 日 6:00,渐冻症的全球首款对因治疗药物托夫生,在北京大学第三医院(以下简称:北医三院)开出首方。
一名 43 岁女性患者接受托夫生注射液腰穿鞘内注射治疗,标志着这款药物正式应用于我国临床。[1]
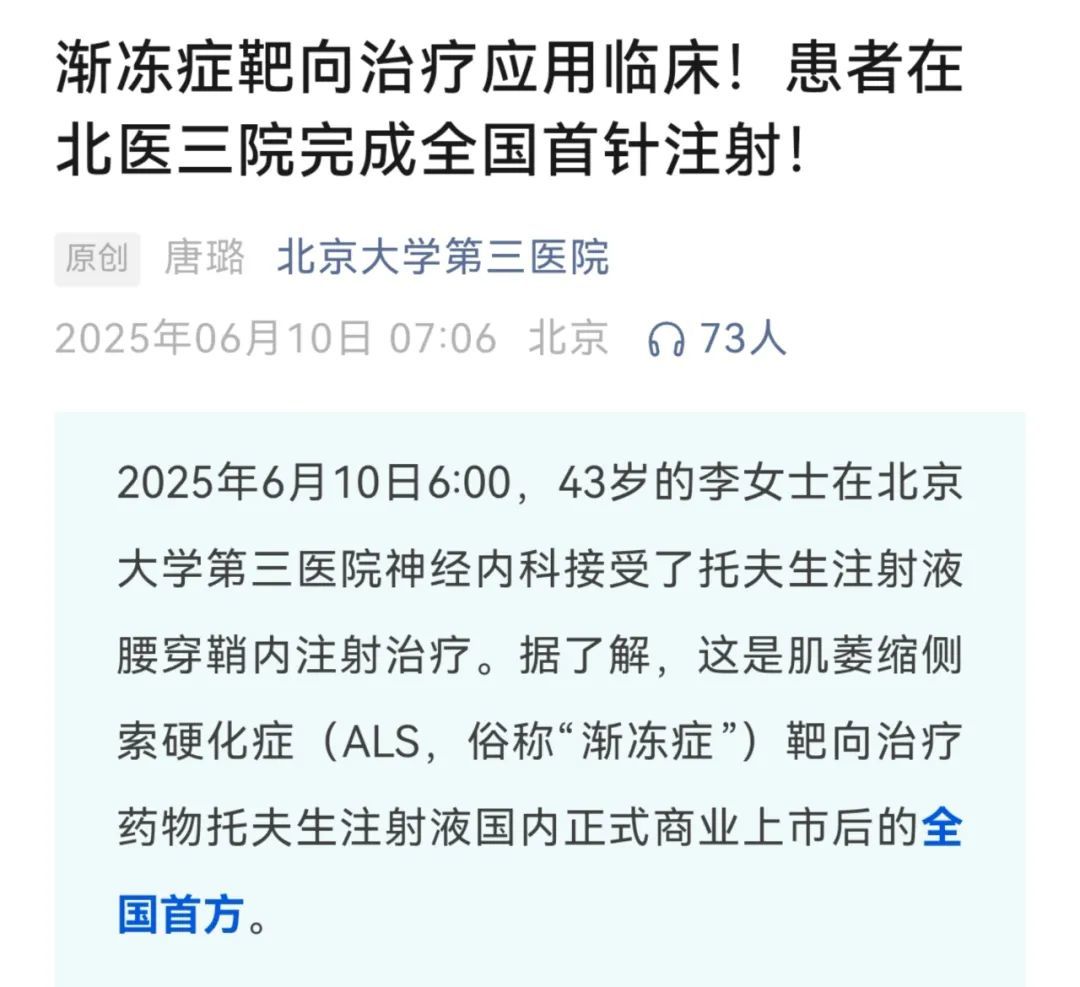
图源:北医三院官微 [1]
截至目前,托夫生国内公开售价尚未披露。据所属公司渤健(Biogen)的发言人 2023 年透露,托夫生在美国的售价为每剂 14,230 美元(约合人民币 10.2 万),患者第一年至少需使用 14 剂,总计 199,200 美元(约合人民币 143 万)。[2]
全球首款对因药,今日北京开出首方
曾经一场火遍全球的「冰桶挑战赛」让人们了解了学名为 ALS 的「渐冻症」。
这是一种进行性、致命的神经退行性疾病,影响大脑和脊髓的运动神经元,导致肌肉无力、瘫痪并最终死亡。[3]
很长一段时间,渐冻症的治疗目标以减缓病情进展和改善症状为主,随着基因检测技术的快速发展,针对渐冻症的药物开发也逐渐转为针对病因。
截至目前,已发现超过 40 个基因与渐冻症相关,可解释大约 70% 的家族性渐冻症和大约 15% 的散发性渐冻症的病因。其中 4 个基因的相关性最为显著:C9orf72、SOD1、FUS 和 TARDBP。[3,4]
托夫生就是一种 SOD1 基因靶向药物。
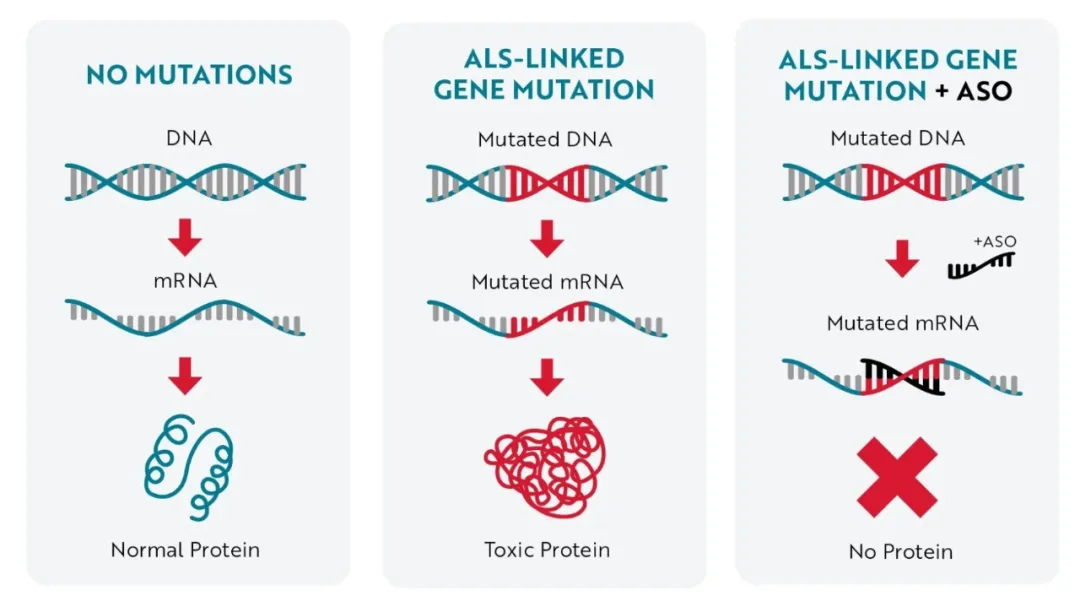
托夫生作用机制,图源:参考资料 5
SOD1 基因突变会产生异常的毒性蛋白,当这些毒性蛋白不断积累,就会引起细胞功能障碍,导致渐冻症患者出现神经退化和肌肉无力。托夫生通过靶向突变 SOD1 基因产生的 mRNA,可有效减少毒性 SOD1 蛋白的合成。[3]
2023 年 4 月,托夫生正式获 FDA 批准,成为全球首个获批的渐冻症对因治疗药物。去年 10 月 8 日,托夫生获得国家药品监督管理局(NMPA)批准上市,正式进入我国。[6,7]
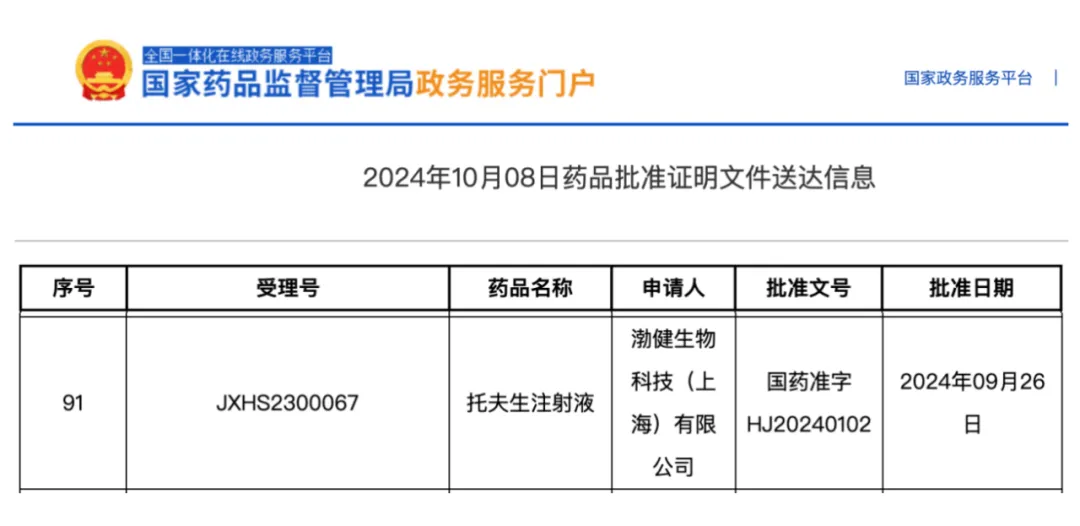
图源:参考资料 7
国内获批大半年后,今日早晨 6:00,托夫生在北医三院开出国内首方。
据北医三院官微介绍,接受首方的患者为一名 43 岁女性,因不明原因的进行性肌肉无力来到北医三院就诊,很快被确诊为 SOD1-ALS(即 SOD1 基因突变所致的成人渐冻症),在神经内科与药学部的紧密协作下,成为国内正式商业上市后,第一个接受托夫生注射的患者。[1]
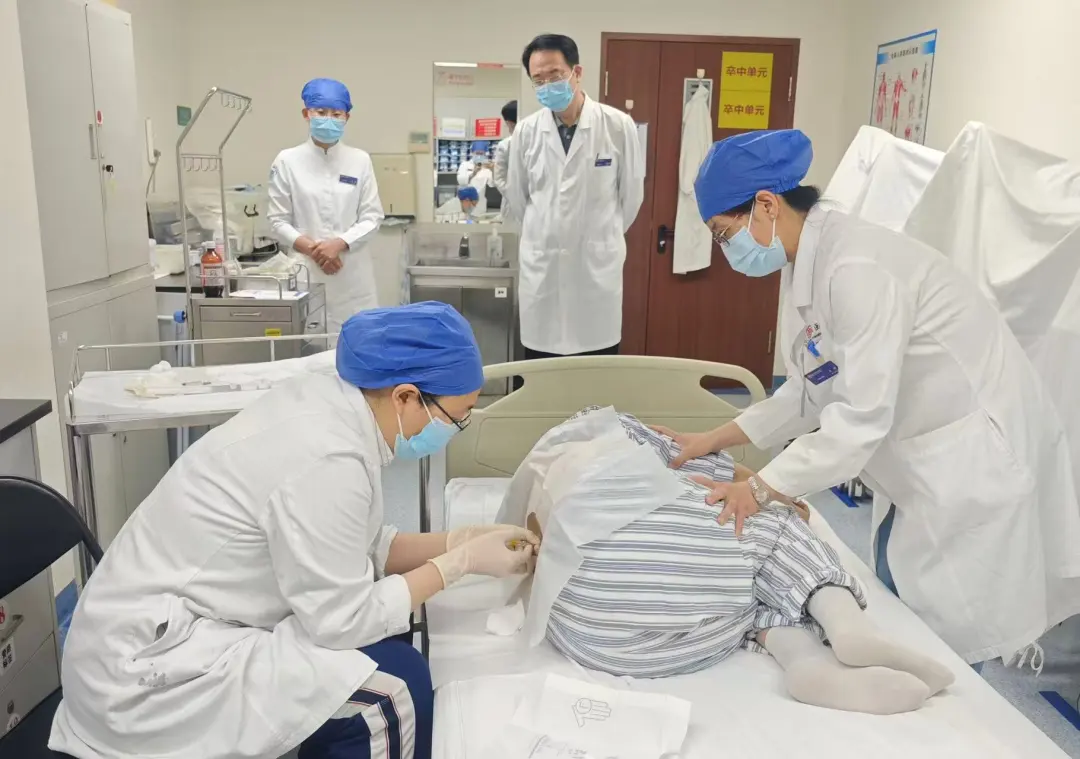
患者接受托夫生注射,图源:北医三院 [1]
获批进程一路绿灯,争议与希望并存
不过要说起托夫生的获批之路,可谓是十分顺畅但争议不断。
2023 年提交 FDA 审批时,托夫生的 III 期临床并未完全完成,但它仅仅凭借「可显著降低血浆神经丝轻链 (NfL)」(NfL 是一种评估渐冻症进展的常用指标,被认为是神经元损伤的标志物),就让 FDA 以「药物被证明对替代终点有影响,该终点很可能预测患者临床获益」为理由,加速审批了托夫生。[6]
图源:FDA [6]
不过,对于某些严重疾病或未满足的医疗需求,FDA 确实允许以「替代终点」为依据(而非实际临床疗效)批准药物尽快上市。同时,这类审批要求对药物继续进行以实际临床疗效为重点的新临床试验。如果后续的临床试验未能证明该药物的临床获益,FDA 有权撤销批准。[8]
与此同时,在中国临床试验注册中心官网以「托夫生」或其英文名称、商品名检索时发现,并无已注册的临床试验。这表明,托夫生在国内很可能是通过免临床途径获批上市。
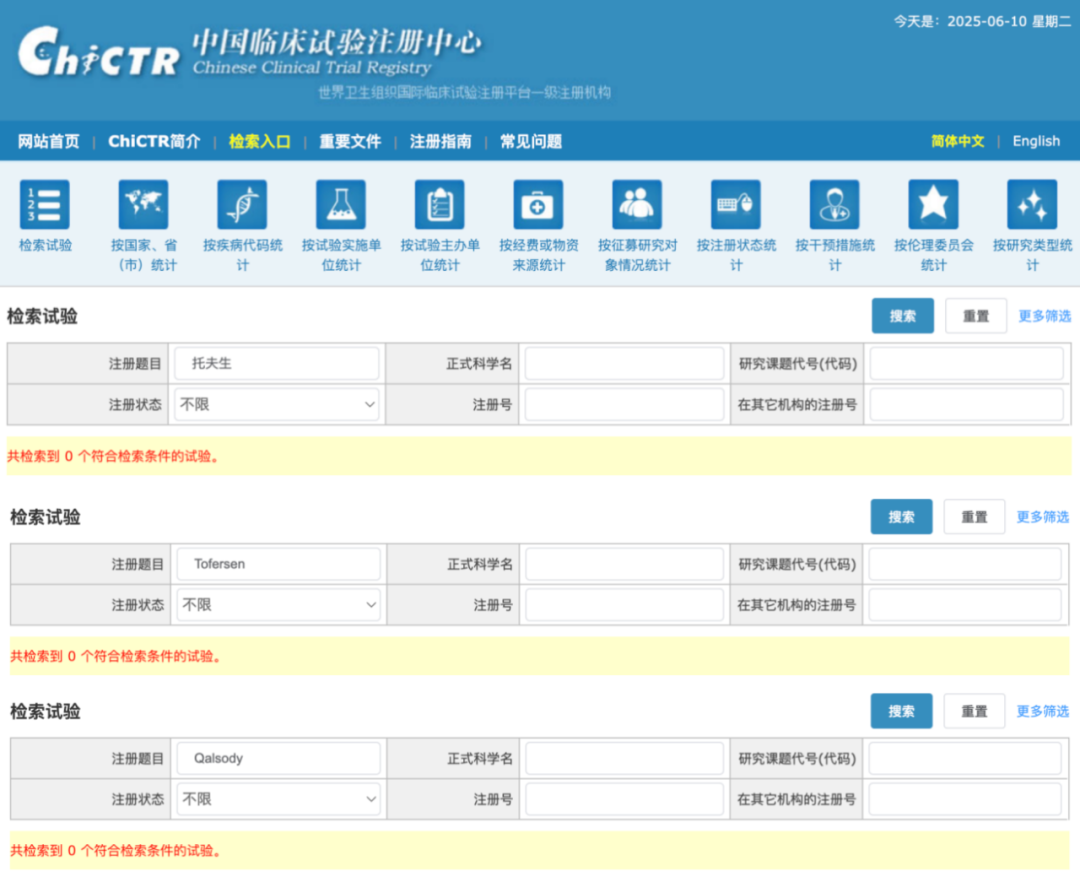
图源:中国临床试验注册中心官网
不过,对于像渐冻症这样的领域来说,能获批就是好事,有争议,也是好事。
审批程序的设置,是基于对疾病的考量;而加速程序的设置,是对患者群体急迫用药的关怀。
正如一位医学协会首席科学官说的那样:「即使临床数据存在问题,但我们必须权衡科学标准与生活残酷的现实,至少让患者有一些尝试的希望,而不是让他们为了获得一些更加确定的积极结果,继续苦等数年。」[9]
策划:肯德羊|监制:islay
编辑:ifhealth 来源:丁香园
