据礼来(Eli Lilly and Company)官网,治疗阿尔茨海默病的新药多奈单抗注射液(Donanemab)获得美国 FDA 批准进行标签更新,新增推荐滴定给药方案,新方案采用更渐进的剂量递增方式。[1]
多奈单抗注射液是每月一次的淀粉样蛋白靶向治疗药物,适用于早期症状性阿尔茨海默病(AD)患者,包括轻度认知障碍(MCI)以及确诊存在淀粉样蛋白病理的 AD 轻度痴呆症患者。[2,3]
多奈单抗是靶向 β 淀粉样蛋白的单克隆抗体,能特异性结合名为 N3pG 的淀粉样蛋白亚型。通过靶向这一亚型,多奈单抗能够特异性地与大脑中的淀粉样斑块相结合,从而促进淀粉样斑块的清除。该疗法在去年 7 月获得美国 FDA 批准,用于治疗出现早期症状的 AD 患者。
此前,多奈单抗已在国内获批,详情参见:全球首款!每月 1 针,不用终身服药,刚刚在国内开打了。
其新研究显示,新滴定方案显著降低与水肿/积液相关的淀粉样蛋白相关影像异常(ARIA-E)的发生率,同时仍实现了相似水平的淀粉样蛋白斑块清除和 P-tau217 减少。
ARIA-E 是针对包括多奈单抗在内的靶向淀粉样斑块的疗法的副作用,通常无症状,但也可能发生严重甚至致命的事件。
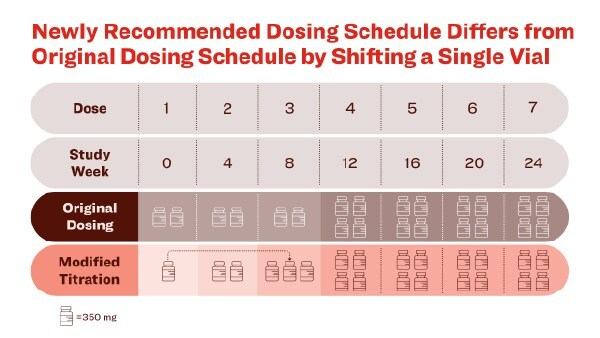
这次批准标签更新主要是依据 TRAILBLAZER-ALZ 6 研究结果。与原方案相比,新滴定方案在 24 周时将 ARIA-E 发生率降低了 41%,在 52 周降低了 35%。
新滴定方案与原方案差异在于:将第一剂中的一个小瓶剂量延后到第三剂,在第 24 周前提供相同剂量药物。该方案在不影响多奈单抗注射液原有每月一次、有限疗程治疗潜力的基础上,减少了 ARIA-E 发生率。[4~7]
TRAILBLAZER-ALZ 6 研究主要发现:
主要终点:接受新滴定方案的患者 ARIA-E 的发生率为 14%,而接受原始给药方案的为 24%,相对风险降低 41%。第 52 周时,新方案组患者 ARIA-E 发生率为 16%,原始方案组为 25%,相对风险降低 35%。[7]
ARIA 发生情况:第 52 周时,包括无症状放射影像学事件在内,新方案组患者 ARIA、ARIA-E 和 ARIA-H 的发生率分别为 29%、16% 和 25%。ARIA-E 和 ARIA-H 是不同类型的淀粉样蛋白相关影像学异常(ARIA)。ARIA-E 为水肿型,ARIA-H 为含铁血黄素沉积型。
疗效方面:新滴定方案组与原方案组患者淀粉样斑块和 P-tau217 的减少情况相当。在 24 周时使用 PET 评估结果显示,新滴定方案组与原方案组患者的淀粉样斑块水平分别降低 67% 和 69%。[8,9]
安全性:研究中未发现新的不良反应,但观察到超敏反应和输注相关反应的发生率较高
编辑:ifhealth 来源:丁香园
